الفرق بين الفلزات واللافلزات مع جدول الاختلاف
الفرق بين الفلزات واللافلزات يبحث عنه شريحة كبيرة من الطلاب، ونظرًا لكونها وأشباهها هو ما يميز جميع العناصر الموجودة في عالمنا، فإن الفرق بينهما يهم الكثير من الناس.
جميع العناصر في عالمنا تم وضعها ضمن جدول لتصنيفها، وذلك طبقًا لعددها الذري، وعدد الإلكترونات الموجودة في مستويات طاقة خاصة بكل عنصر.
مما كانت نتيجة التصنيف في هذا الجدول إلى ثلاث أقسام، وهي الفلزات، واللافلزات، وأشباهها، فإن كنت تبحث عن الفرق بينهم، فتابع معي هذا المقال لتتعرف على ذلك.
ما هي الفلزات؟
إن تعريف الفلزات هو عبارة عن المواد المعدنية التي تستطيع أن تفقِد إلكترونًا أو أكثر، مما يؤدي إلى تشكيل أيونات أو كاتيونات موجبة، وتمتلك الفلزات رابطة فلزية خاصة بها، تعمل على ربط ذراتها ببعضها.
في الحقيقة، فإن العناصر الموجودة في الجدول الدوري معظمها يكون مصنفًا على أنه من الفلزات، وأحد أكثر الأمثلة عليها هي: النحاس، الفضة، الزنك، الذهب، الحديد، النيكل.
ما هي أنواع الفلزات
تمتلك الفلزات العديد من الأنواع الخاصة، ويختلف كل نوع عن الآخر من حيث خواصه الكيميائية، واسمه، وسرعة التفاعل أيضًا، وهذه الأنواع هي:
الفلزات القلوية
يوجد ستة عناصر من الجدول الدوري مصنفة بأنها فلزات قلوية، وهي تشكل المجموعة الأولى من عناصر الجدول الدوري.
وتتميز هذه العناصر بكونها شديدة التفاعل، مثل الصوديوم والبوتاسيوم، بالإضافة إلى أنها تمتلك نقطة انصهار منخفضة.
فمثلًا ينصهر عنصر البوتاسيوم عند درجة حرارة 64 درجة مئوية تحت الصفر. ويعود تسمية تلك العناصر الفزيّة بالفلزات القلوية.
نظرًا لكون محاليلها المائية تمتلك خواص قلوية، أي عندما تتفاعل أحد هذه العناصر مع الماء، فإنها تكون عناصر قلوية.
الفلزات الترابية
كذلك تمتلك القلويات الترابية 6 عناصر من الجدول الدوري، مثل الكالسيوم، والمغنيزيوم، والباريوم، وهذه المجموعة تمثل المجموعة الثانية من عناصر الجدول الدوري.
هذه العناصر تكون موجودة بصورة مرتفعة في قشرة الأرض، ولا تمتلك صفة تفاعل قوية مثل الفلزات القلوية، لكنها تتسم بالصلابة، وتمتلك درجة انصهار عالية أكثر من الفلزات القلوية.
الفلزات الانتقالية
هي أحد أكثر أنواع الفلزات التي يفضلها الكثير، وذلك لكونها لامعة وصلدة وقوية، كما أنها تمتلك نقطة انصهار مرتفعة.
أما عند شدة تفاعلها، فإنها تتفاعل بشدة أقل من الفلزات القلوية والفلزات الترابية، ومن أمثلتها: والنحاس، والكروم.
هذه العناصر تتميز بسهولة تشكيلها، ويتم ذلك بواسطة السحب والطرق فقط، وهذا ما يؤهلها للدخول في الكثير من الصناعات.
اقرأ أيضا بحث عن الكيمياء
الفلزات الضعيفة
الفلزات الضعيفة كثيرة جدًا، حيث يبلغ عدد عناصرها 19 عنصرًا في الجدول الدوري، ومن أبرزها: الأنتيمون، القصدير، الرصاص، الإنديوم، البولونيوم، الألمنويوم.
هذه المجموعة تقع على الطرف الأيمن من مجموعة الفلزات الانتقالية ضمن الجدول الدوري، وتتسم هذه العناصر بأنها طرية، ولا يمكن استخدامها إلا بإضافة أحد المواد الأخرى إليها، لتضيف إليها الصلابة والقوة.
اقرأ أيضا: بحث عن الهيدروكربونات
الفلزات النبيلة
إن عناصر مجموعة الفلزات النبيلة تكون موجودة في قشرة الأرض، ولكن تكون مستقلة عنها، أي توجد هذه العناصر بشكلها الخام، ومن أبرز الأمثلة عليها: القصة، الذهب، البلاتين.
خصائص الفلزات
هناك العديد من الخصائص التي تمتلكها الفلزات، وهي:
- تعتبر الفلزات عناصر مرنة، ورغمَ ذلك فإنها صلبة ومتينة، وتتميز بامتلاكها نقاط انصهار ونقاط غليان منخفضة.
- الفلزات تفقد الإلكترونات، مما يجعلها قادرة عل تشكيل الأيونات الموجبة.
- يتم تشكيل روابط أيونية بين ذرات الفلزات، ويمكن أن تتشكل هذه الروابط بين الفلزات واللافلزات.
- من الصعب جدًا فصل ذرات الفلزات عن بعضها، لأنها تمتلك روابط داخلية قوية، إضافةً إلى الروابط الأيوينة.
ما هي اللافلزات
هي جميع العناصر الكيميائية التي تمتلك كهرسلبية كبيرة، وهذا ما يؤدي إلى جعلها بحاجة إلى اكتساب إلكترونات حتى تصل إلى مرحلة الاستقرار.
وتستطيع ذرات عناصر اللافلزات أن تشكل روابط تساهمية مع ذرات عناصر لا فلزية أخرى، وبحيث تتشارك هذه العناصر إلكترونًا بينها.
لتشغل مستوى الطاقة الأخير، كما بإمكان ذرات العناصر اللافلزية أن تكون رابطة أيونية مع ذرات عناصر فلزية، ويتم ذلك بكسبها إلكترونًا تمنحها إياه، أو تكسب الإلكترون الذي تفقده ذرات العناصر الفلزية.
هناك العديد من الأمثلة، ومن أهمها:
الأوكسجين، الكربون، اليود، الكبريت، الفوسفور، الكلور، وغيرهم الكثير.
اقرأ أيضا: بحث عن الرابطة التساهمية القطبية والغير قطبية
ما هي خصائص اللافلزات؟
عناصرها كثيرة الاستخدام في مجالات معينة، ولكن لا بد من معرفة جميع الخصائص التي تتمتع بها، وهي:
- إن عناصر المواد اللافلزية لا تمتلك خاصية التوصيل الكهربائي، ولا خاصية التوصيل الحراري، ولكن باستثناء الجرافيت وغاز الكربون، فهما قادران على توصيل الكهرباء والحرارة، ولكن بدرجة ضئيلة جدًا.
- تتسم مواد اللافلزات بالضعف والهشاشة، وبالتالي لا يمكن طيّها، أو تشكيلها على شكل سبائك، إضافةً إلى عدم قدرتها على وضعها داخل الأسلاك الكهربائية.
- هناك تفاعلات تحدث بين الفلزات واللافلزات، وهذه التفاعلات نسبتها أكبر من نسبة تفاعل اللافلزات مع بعضها البعض، وتفاعل اللافلزات مع بعضها يحتاج إلى درجة حرارة عالية جدًا حتى يتم التفاعل.
- أكثر عناصر اللافلزية لا تستطيع التفاعل مع الهواء في درجة حرارة الغرفة، لكن هناك عنصر واحد من اللافلزات يتفاعل مع الهواء، وهو الفوسفور الأبيض، الذي بإمكانه التفاعل مع الهواء، ويتشكل نتيجة لهذا التفاعل مركب أوكسيد الفوسفور، وذلك من خلال الاحتراق.
- لا يمكنها أن تتفاعل مع الماء، ولكن يستطيع الكلور فقط التفاعل مع الماء، فيذوب داخله مكونًا محلولًا حمضيًا.
- كثافتها منخفضة.
- وتتميز أيضًا بوجودها بجميع أطوار المادة، سواءً الغازية، أو الصلبة، أو السائلة، وذلك ضمن درجة حرارة الغرفة.
- لا تمتلك خاصية انعكاس الضوء عليها، كما أنها لا تمتلك بريقًا معدنيًا.
- إن نقطة انصهارها تكون أقل من نقطة انصهار مواد الفلزات، ورغم ذلك، إلا أنها تتغير بشكل شديد تبعًا لكل مكون، وهذا ما نجده أيضًا في درجة الغليان.
جدول الفرق بين الفلزات واللافلزات
يمكن التفريق والتمييز بينهم بين الكثير جدًا من الجوانب، وسنذكر لكم الكثير من تلك الجوانب، حتى نشمل أهم ما يميز الفلزات عن اللافلزات.
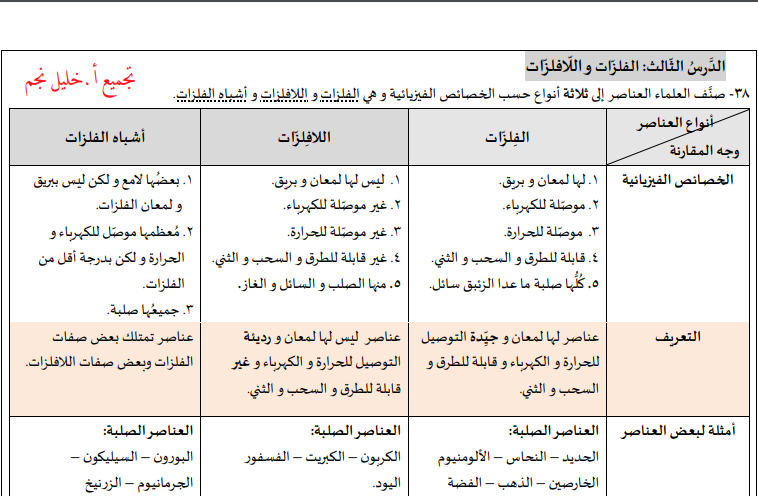
الفرق من حيث التعريف
إن الفلزات هي عبارة عن عناصر ذات تعدّد، وتتغلب الفلزات على اللافلزات في وجودها بشكل أكبر في الطبيعة، وتوجد الفلزات في القشرة الأرضية.
وتتميز الفلزات بأنها ذرات عناصرها تكون مرتبة بشكل بلوري ومنتظم، ومن أهم ما يميزها بأنها تمتلك خصائص اللمعان، والتوصيل الكهربائي.
أما اللافلزات فهي عبارة عن العناصر التي تمتلك خصائص معاكسة لخصائص الفلزات، حيث لا تستطيع توصيل الكهرباء، إضافةً إلى أن عدد عناصرها أقل من عدد عناصر الفلزات، ولكن انتشارها كبير جدًا في الطبيعة.
اقرأ أيضا بحث عن تكون الأيونات
الفرق من حيث مجموعات الجدول الدوري
جميعنا يعرف أن الجدول الدوري يكون مرتبًا وفق أعمدة، وكل مجموعة منه تمتلك عدة خصائص مشتركة، وبالنسبة للفلزات.
فإنها تشكل ما يقارب 80 بالمئة من عناصر الجدول الدوري، ومعظم هذه العناصر توجد في الجزء الأيسر من الجدول.
أما اللافلزات فإنها تشغل الجزء الأيمن من عناصر الجدول الدوري، وتشمل هذه العناصر مجموعتين، وهما الغازات النبيلة، والهالوجينات، إضافةً إلى 8 عناصر مستقلة.
الفرق من حيث اللمعان
يمكن التمييز بين الفلزات واللافلزات بواسطة المظهر الخارجي لكل من العناصر الصلبة منهما، حيث تتسم المعادن الفلزية بامتلاكها خاصية اللمعان، فهي قادرة على عكس الضوء الذي يسقط عليها، مثل النحاس.
في حين أن اللافلزات لا تستطيع عكس الضوء الذي يسقط عليها، وذلك بسبب قدرتها على امتصاص أشعة الضوء، مما لا يجعلها تتصف باللامعة، وهذا ما يجعل من ألوانها قاتمة.
الفرق من حيث القدر على توصيل الكهرباء
إن الفلزات تحتوي في مدار ذرتها الأخير على إلكترونات حرة الحركة، مما يعطيها القدرة على توصيل الكهرباء، ومن ابرز الأمثلة على مادة فلزية هو النحاس.
في حين أن عناصر اللافلزات غير قادرة على التوصيل الكهربائي، وذلك بسبب عدم امتلاكها إلكترونات حرة الحركة، بل إن إلكترونات مدارها الأخير مقيدة.
الفرق من حيث توصيل الحرارة
كما هو الحال في اعتماد توصيل الكهرباء على حرية الإلكترونات في المدار الأخير من الذرة، فإن توصيل الحرارة يعتمد على حرية الإلكترونات أيضًا، وهذا ما يجعل الفلزات قادرة على التوصيل الحراري بشكل جيد.
في حين أن اللافلزات غير قابلة للتوصيل الحراري، وذلك بسبب تقيد الإلكترونات في المدار الأخير من ذرات عناصرها.
الفرق من حيث حالة المادة
جميع عناصر الفلزات تكون بالحالة الصلبة بشكل دائم ضمن درجات الحرارة الطبيعية، ولكن الزئبق هو الفلز الوحيد الذي يكون بالحالة السائلة في درجات الحرارة الطبيعية.
أما اللافلزات، فموادها تأخذ جميع حالات المادة، فهناك مواد لافلزية صلبة مثل الكربون، وهناك مواد لافلزية سائلة مثل البرومين، ولافلزات غازية، حيث أي مادة غازية تكون لافلزية.
الفرق من حيث المطاوعة
إن الفلزات تمتلك خاصية المطاوعة، أي أنه يمكن تشكيل أشكال منها بالطرق والسحب، وتشكيل الصفائح وأسلاك منها.
ويعود ذلك إلى امتلاك روابط ذراتها خاصية المرونة، وأحد الأمثلة على ذلك، هو قدرة الذهب أو الفضة على تشكيل أسلاك رفيعة منه.
في حين أن اللافلزات الصلبة لا تمتلك خاصية المطاوعة، فلا يمكنها التشكل.
الفرق من حيث الكثافة
إن الفلزات تتميز بكونها تمتلك كثافة عالية، حيث يعتبر وزنها أكبر نسبيًا من حجمها.
ويعود سبب ذلك إلى أن الذرات متراصة فيما بينها، ومن أحد الأمثلة على ذلك هو عنصر الإيريديوم، الذي يمتلك كثافة عالية.
تعتبر اللافلزات قليلة الكثافة مقارنةً بالفلزات.
الفرق من حيث درجة الانصهار
إن درجة الانصهار هو درجة الحرارة الكافية لتحويل المادة من حالتها الصلبة إلى حالتها السائلة، وبالنسبة للفلزات.
فإن درجة انصهارها تكون عالية بصورة عامة، وأحد الأمثلة على عنصر من الفلزات هو التنغستون، فهذا العنصر يمتلك درجة انصهار عالية جدًا، حيث تبلغ درجة الانصهار لهذا العنصر حوالي 2000 درجة مئوية.
أما اللافلزات، فإن درجة انصهارها تكون قليلة نسبيًا بالنسبة للفلزات، ولكن تتغير هذه الدرجة بصورة كبيرة من لافلز إلى آخر.
الفرق من حيث تشكيل الكاتيونات
إن الكاتيونات هي عبارة عن أيونات تحمل شحنة موجبة، أي يكون عدد البروتونات أكبر من عدد الإلكترونات داخل الذرة.
ومعظم عناصر الفلزات تميل نحو فقدان إلكترون، خاصةً العناصر الموجودة في المجموعة الأولى والمجموعة الثانية، فإنها تميل لتتحول إلى كايتونات.
أما اللافلزات، فإن لا تميل أبدًا إلى فقدان إلكترون، بل يميل إلى كسب إلكترون، مما يجعل اللافلزات تميل إلى تشكيل أيونات سالبة، والتي تُسمى أنيونات.
الفرق من حيث الكهرسلبية
تُعرَّف الكهرسلبية بأنها قدرة العنصر الكيميائي ضمن الجدول الدوري على كسب إلكترون، وذلك عند تشكيل الرابطة الكيميائية.
والكهرسلبية يُعبَّر عنها بقيمة عددية دون أي واحدة قياس. وكما تحدثنا سابقًا، فإن الفلزات تميل لتفقد إلكترون.
وهذا ما يجعل قيمة الكهرسلبية لديها منخفضة، في حين أن اللافلزات تميل لتكتسب إلكترونات، مما يجعل قيمة الكهرسلبية لديها مرتفعة.
في الختام، فقد قدمنا إليكم في هذا المقال أهم المعلومات التي تشرح الفرق بينهم، وأرجو أن يكون المقال عد أفادكم، دمتم بخير.



