بحث عن تكون الأيون كامل
ندعم أبنائنا الطلاب بـ بحث عن تكون الأيون هو أحد مجالات الكيمياء، التي تعتبر علمٌ واسعٌ جدًا، ولا يمكن حصره بالاكتشافات والدراسات التي توصل إليها علماء الكيمياء، بل ما زال إلى يومنا هذا علوم ومعلومات وأشياء لم يتم التوصل إليها بعد.
كلنا نسمع عن اسم الذرة، والذي يمكن القول عنه أنه أصغر جزء من المادة، وهذه الذرة يُجرى عليها الدراسات والأبحاث، فمثلًا إلى الآن لم يتم إثبات شكلها الحقيقي بنسبة كاملة.
هذه الذرة لها مكونات وأجزاء، وكل جزءٍ منها له صفات وخواص معينة مختلف عن الآخر.
اليوم سنتحدث عن أحد أصغر أجزاء المادة، وهو الأيون، وسأحدثكم عن مكوناته، وكيفية تشكله، لذلك؛ تابعوا معنا اليوم بحث عن تكون الايون.
بحث عن تكوين الرابطة الايونية ثاني ثانوي doc
قبل أن نقوم بتعريف الأيون، يجب تعريف الذرة، والذرة هي أصغر جزء من المادة، وتتكون من نواة الذرة، والإلكترونات.
توضع الإلكترونات حول النواة على سويات طاقة مختلفة، تتألف نواة الذرة من البروتونات والنيوترونات، وتمتلك نواة الذرة شحنة موجبة، لأن البروتونات تكون موجبة الشحنة، بينما الإلكترونات تكون مشحونة بشحنة سالبة.
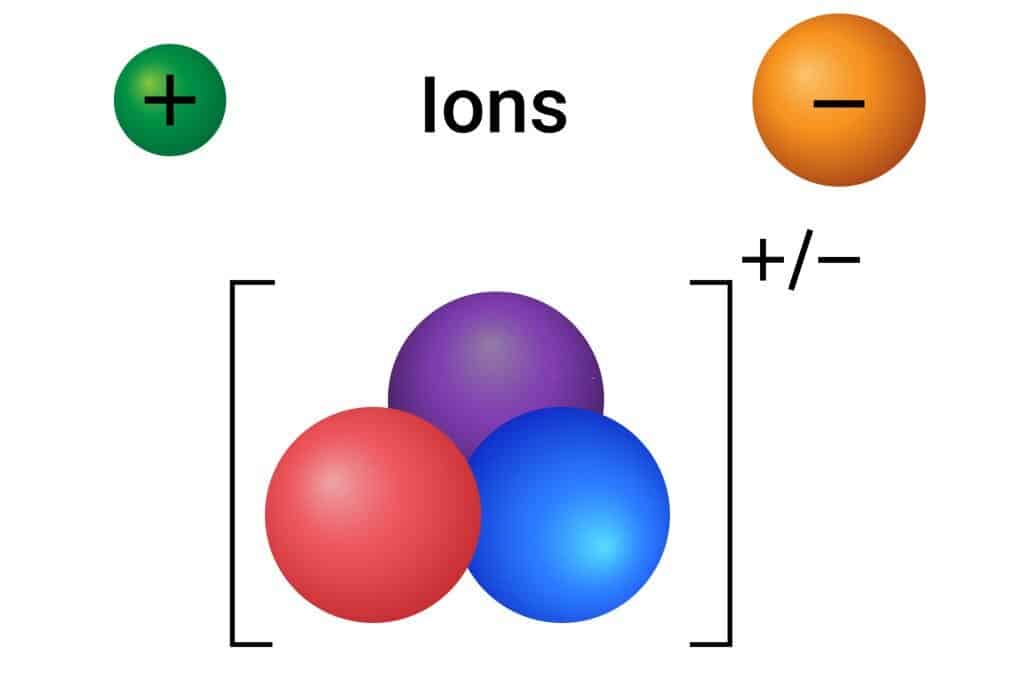
عندما يختل تكوين الذرة بحيث يفقد أو يكتسب إلكترونًا واحدًا أو أكثر، فإن الذرة تتحول لتصبح أيون.
أي يمكن تعريف الايون على أنه ذرة فقدت أو اكتسبت إلكترونًا واحدًا أو أكثر، وبما أن الذرة ستفقد أو تكسب إلكترونًا، فستتحول شحنتها، إما لتكون موجبة أو سالبة.
وهذا يعني أن الأيون له نوعان، أيون موجب، وأيون سالب.
أول من أطلق على الذرة التي تخسر أو تكسب إلكترونًا أو أكثر “بالأيون” إلى الكيميائي الإنجليزي مايكل فاراداي، وذلك في سنة 1834.
وقد استخدم هذا الاسم لتوصيف تركيب كيميائي الذي ينتقل من حالة قطب كهربائي إلى حالة أخرى في محلوله المائي.
اقرأ أيضًا عن: تخصصات جامعة الملك فيصل
كيف يتشكل الأيون؟
كما ذكرتُ في الفقرة السابقة، فإن الذرة تتألف من الإلكترونات والبروتونات والنيوترونات، والإلكترونات تكون سالبة، والبروتونات تكون موجبة، بينما النيوترونات تكون عديمة الشحنة.
وتحتوي كل ذرة على عدد من الإلكترونات يكون مساوٍ لعدد البروتونات، وبذلك تتساوى الشحنتان الموجبة والسالبة، أي أن الذرة تكون غير مشحونة.
وتسمى في هذه الحالة ذرة محايدة، ويمكن تعريفها بأنها ذرة لا تحتوي على شحنة إجمالية. مثالٌ عليها هو ذرة عنصر الكربون، الذي يحتوي على 6 إلكترونات.
وتحتوي نواة ذرته على 6 بروتونات، أي أن عدد الشحنات الموجبة (البروتونات) تساوي عدد الشحنات السالبة (الإلكترونات).
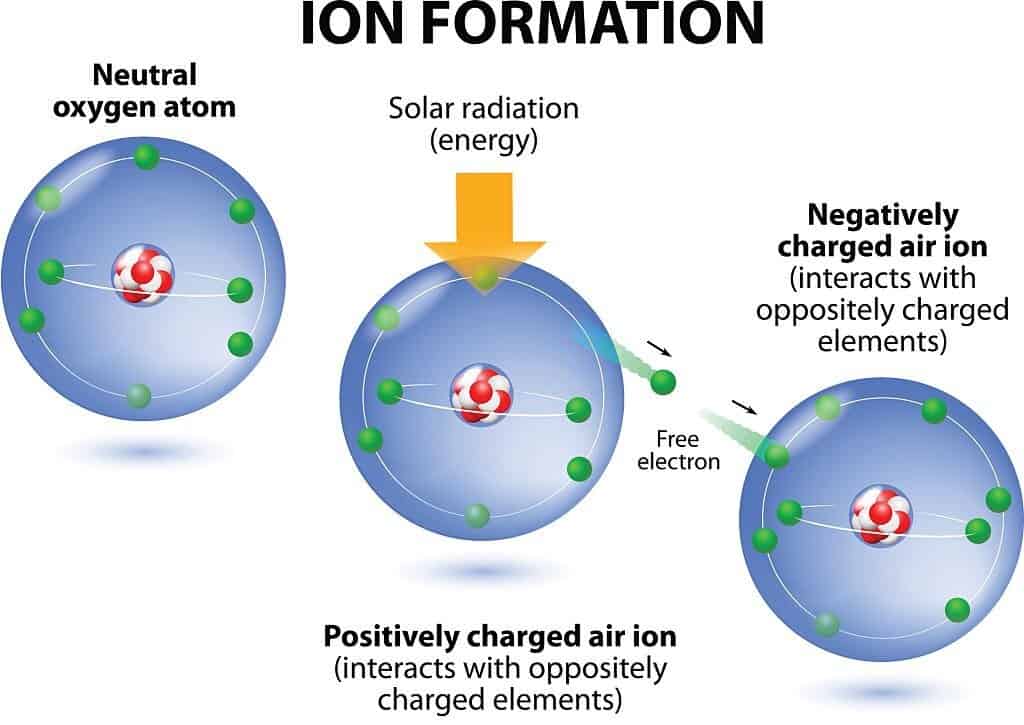
بالنسبة للأيون، فكما ذكرتُ في الفقرة السابقة أيضًا، فهو عبارة عن ذرة ذات شحنة، إما تكون موجبة أو سالبة. الذرة عندما تكتسب إلكترونًا واحدًا.
فإن عدد الإلكترونات الإجمالي فيها أصبح أكثر من عدد البروتونات، وهذا يعني أن عدد الشحنات السالبة أكبر من عدد الشحنات الموجبة، وبالتالي أصبحت الذرة سالبة الشحنة.
بينما إذا فقدت الذرة إلكترونًا واحدًا، فسيصبح عدد البروتونات أكبر من عدد الإلكترونات، أي أن عدد الشحنات الموجبة أكبر من عدد الشحنات السالبة، فتصبح لدينا ذرة موجبة الشحنة، أي أيون موجب.
اقرأ أيضا بحث عن الرياضيات
لماذا يتكون الايون؟
عندما تفقد أو تكسب الذرة إلكترونًا واحدًا أو أكثر، وتشكل الأيون، فإنها تهدف بذلك لترتبط مع ذرات أخرى بهدف الاستقرار.
تقوم الأيونات عادةً بالارتباط بذرات أخرى، أو بمركب يحتوي على شحنة، وذلك بواسطة تفاعل كيميائي ينتج عنه تكوّن جزيء مستقر ومحايد.
الجزيء هو عبارة عن ذرتين أو أكثر ارتبطوا ببعضهم البعض تحت التفاعل الكيميائي، ويتم هذا الترابط بواسطة الروابط الكيميائية.
الذرة تحتوي على الإلكترونات التي تحيط بها، والتي توضع في مستويات طاقة مختلفة بعيدًا عن النواة. كل مستوى من الطاقة يتضمن عدد معين من الإلكترونات.
ولكن، فإن الإلكترونات الخارجية هي التي تقوم بتشكيل الرابطة الكيميائية، أي أنها هي التي تشارك في التفاعل الكيميائي. هذه الإلكترونات تُسمى بإلكترونات التكافؤ.
عدد إلكترونات التكافؤ يختلف من ذرة عنصر إلى آخر، ويمكن معرفة عدد إلكترونات التكافؤ من الجدول الدوري الخاص بالعناصر الكيميائية.
إن أكثر عدد لإلكترونات التكافؤ الموجودة في مستويات الطاقة الخارجية هو 8 إلكترونات، وهذا ما يعبر عن قاعدة الثمانيات.
ما هي أنواع الأيونات؟
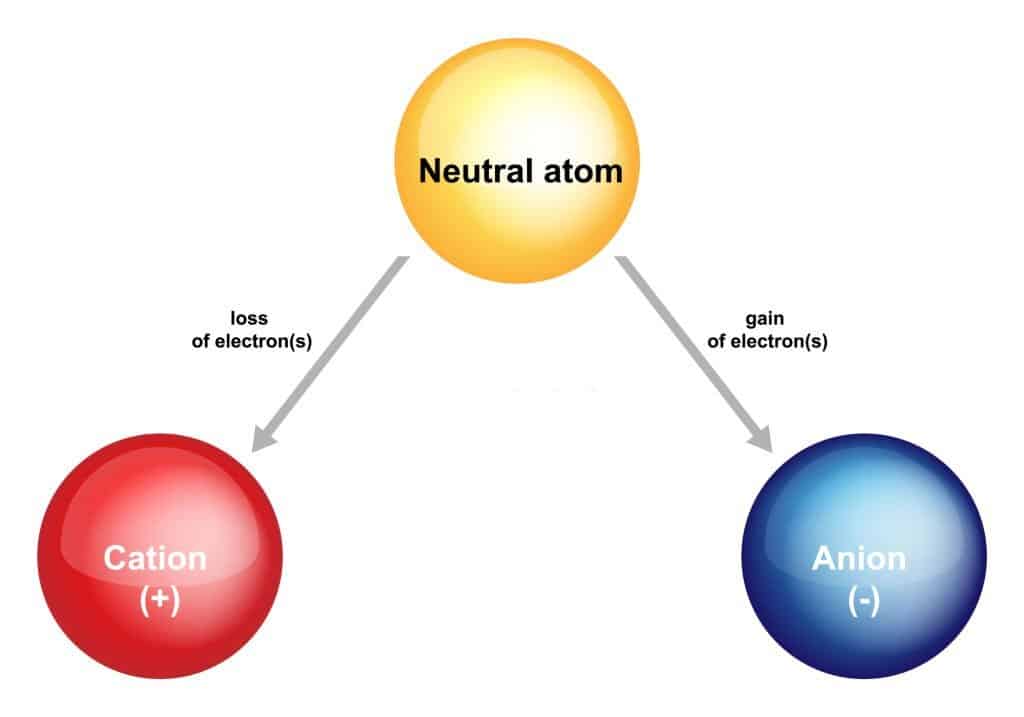
إن الأيون له نوعان مختلفان، وهما الكاتيونات والأنيونات، عندما تفقد الذرة إلكترونًا، فإن شحنتها تصبح موجبة، لأن عدد البروتونات ذات الشحنة الموجبة تصبح أكثر عددًا من الإلكترونات ذات الشحنة السالبة.
اقرأ أيضا بحث عن نظرية فيثاغورس
وفي هذه الحالة تصبح الذرة أيون موجب، وهذا النوع هو الكاتيونات.
بينما إذا اكتسبت الذرة إلكترونًا، فإنها ستصبح ذرة سالبة، وتتحول إلى أيون سالب، وفي هذه الحالة يسمى الأيون بالأنيون.
- الكاتيونات تحتوي على بروتونات أكثر من الإلكترونات.
- الأنيونات تحتوي على إلكترونات أكثر من البروتونات.
خواص المركبات الأيونية
إن المركبات الأيونية تمتلك خواص خاصة فيها، وهي التي تجعلها متميزة عن المركبات الأخرى، ومن أهم خواصها:
- المركبات الأيونية سريعة الذوبان في الماء، وعندما تذوب في الماء تصبح ناقلة للتيار الكهربائي بشدة، ولكن عندما تكون في الحالة الصلبة، لا تستطيع نقل التيار الكهربائي.
مثال على المحاليل الأيونية: كلوريد الصوديوم. - تذوب هذه المركبات في المذيب القطبي، ولكن لا تستطيع الذوبان في المركبات الغير قطبية.
- يمتلك كل مركب أيوني شكل بلوري خاص به، وتكون هذه البلورات منتظمة.
- تنصهر هذه المركبات تحت درجة حرارة عالية جدًا، حيث تمتلك روابط قوية جدًا بين ذراتها، ولا تتفكك تحت درجة حرارة عادية، بل تحتاج إلى طاقة حرارية عالية، حتى تتفكك هذه الروابط.
بعض التطبيقات التي تعتمد على الأيونات
هناك الكثير من التطبيقات التي تعتمد على المركبات الأيونية في تكونها، ومن أبرزها:
كلوريد الكالسيوم
هو أحد المركبات الأيونية، ويتشكل هذا المركب بسبب انتقال عدد من الإلكترونات من ذرة عنصر الكالسيوم إلى ذرة عنصر الكلور، فتتحول شحنة عنصر الكالسيوم إلى شحنة موجبة، وتصبح شحنة عنصر الكلور سالبة.
ويستخدم كلوريد الكالسيوم في عدة استخدامات في حياة الإنسان، حيث يستخدم في صناعة الأدوية، ويستخدم في التربة لتحسين حالتها، كما يساعد على تثبيت الألوان، لذلك يُستعمل في مجال الطباعة.
ملح الطعام
هو مركب كلوريد الصوديوم، ويتشكل هذا المركب بسبب انتقال إلكترون واحد من ذرة الصوديوم إلى ذرة الكلور، فتتحول ذرة الصوديوم إلى أي أيون موجب.
بينما تصبح ذرة الكلور أيون سالب. على الرغم من أن مادة الكلور تعتبر مادة خطيرة وسامة، والصوديوم مادة ضارة، إلا أن تفاعل المادتين مع بعضهما يجعلهما آمنين.
أكسيد المغنيسيوم
تتشكل هذه المادة عندما ينتقل إلكترونان من ذرات عنصر المغنيزيوم إلى ذرات عنصر الأوكسجين. ويستخدم أكسيد المغنيسيوم في صناعة المكملات الغذائية، كما يُستخدم في صناعة الإسمنت والزجاج.
في الختام، فقد قدمنا لكم بعض المعلومات عن الأيون والمركبات الأيونية، وذلك في بحث عن تكون الأيون، أرجو أن يكون المقال قد أعجبكم.



